DOI: http://dx.doi.org/10.20986/revesppod.2024.1687/2024
REVISIÓN
Estimulación eléctrica percutánea como tratamiento del dolor ocasionado por los síndromes compresivos nerviosos más frecuentes en pie y tobillo. Revisión bibliográfica
Percutaneous electrical stimulation as a pain treatment caused by the most common compressive nerve syndromes in the foot and ankle. Literature review
Laura Regife Fernández1
Marta Moreno Fresco1
Ramón Mahillo Durán1
1Departamento de Podología. Facultad de Enfermería, Fisioterapia y Podología. Universidad de Sevilla, España
Resumen
El dolor crónico desencadena consecuencias emocionales, físicas, económicas y sociales para el paciente, ocasionando así uno de los problemas de salud más costosos para la sociedad. Esta experiencia desagradable se manifiesta en los síndromes de atrapamiento nervioso de múltiples maneras. Es por ello que, ante terapias conservadoras fallidas, la introducción de nuevos tratamientos como la estimulación eléctrica percutánea reflejan mostrar buenos resultados en cuanto a la disminución de la clínica dolorosa. De esta manera, el objetivo principal de esta revisión bibliográfica fue conocer la efectividad de la técnica de estimulación eléctrica percutánea en el tratamiento del dolor neuropático/crónico, ocasionado por los síndromes de atrapamiento nervioso más frecuentes en el pie y tobillo.
Se ha realizado una búsqueda en diversas bases de datos científicas durante los meses de febrero y marzo de 2023. Tras aplicar criterios de inclusión y exclusión, se seleccionaron y analizaron un total de 30 artículos. De estos, 18 cumplieron con los criterios de búsqueda y se incluyeron en la discusión.
Como conclusiones se obtiene que la técnica demuestra su efectividad a corto plazo en cuanto a la reducción del dolor musculoesquelético, neuropático o postoperatorio, así como en la ingesta de medicamentos. Hemos tenido dificultades para evidenciar su efectividad en los síndromes de atrapamiento nervioso en el pie y tobillo, aunque sí para los ocasionados en otras partes del cuerpo. Los autores contrastados utilizan diferentes protocolos de actuación. Si bien la mayoría alternan altas y bajas frecuencias en un intervalo de 20-30 minutos.
Palabras clave: Atrapamiento nervioso, dolor, neuromodulación, PENS, pie, tobillo
Abstract
Chronic pain triggers emotional, physical, economic, and social consequences for patients, thus causing one of the most costly health problems for society. This unpleasant experience manifests in nerve entrapment syndromes in multiple ways. Therefore, in the face of failed conservative therapies, the introduction of new treatments such as percutaneous electrical stimulation reflects promising results in reducing painful symptoms. Thus, the main objective of this literature review is to assess the effectiveness of the percutaneous electrical stimulation technique in the treatment of neuropathic/chronic pain caused by the most frequent nerve entrapment syndromes in the foot and ankle.
A search has been conducted on various scientific databases during the months of February and March 2023. After applying inclusion and exclusion criteria, a total of 30 articles were selected and analyzed. Of these, 18 articles meeting the search criteria were identified and, consequently, included in the discussion.
In conclusion, it is observed that the technique demonstrates its short-term effectiveness in reducing musculoskeletal, neuropathic, or postoperative pain, as well as medication intake. We have encountered difficulties in demonstrating its effectiveness in nerve entrapment syndromes in the foot and ankle, although it has shown efficacy for those occurring in other parts of the body. Established authors employ varied intervention protocols, with the majority alternating high and low frequencies within a 20-30 minute interval.
Keywords: Nerve entrapment, pain, neuromodulation, PENS, foot, ankle
Correspondencia:
Laura Regife Fernández
lauraregife@gmail.com
Recibido: 13-01-2024
Aceptado: 09-03-2024
Introducción
El dolor es una experiencia subjetiva y compleja definida por la asociación internacional para el estudio del dolor como “una experiencia sensorial o emocional desagradable, asociada a una lesión tisular presente o potencial, o que se describe en términos de dicha lesión”(1). Cuando persiste y pasa a ser crónico, los efectos fisiopatológicos y las respuestas de comportamiento que este ocasiona difieren de las asociadas con el dolor agudo. Los datos muestran una incidencia del 25.7 % (1.5 mil millones de personas) a nivel mundial (2), entre un 19 y 31 % en Europa y un 30 % en España(3).
El dolor neuropático es aquel dolor crónico causado por una enfermedad o lesión del sistema nervioso somatosensorial, lo que conlleva a la manifestación de signos y síntomas específicos de hiperexcitabilidad. Entre los dolores de tipo crónico es uno de los que mayor prevalencia presenta con un 6.9-10 %(1).
Un atrapamiento nervioso se define como aquella compresión prolongada sobre un nervio periférico en cualquier punto de su recorrido debido a fuerzas mecánicas extrínsecas o intrínsecas4. Frecuentemente se presentan síntomas que surgen de una combinación del dolor nociceptivo y neuropático(1). Estos ocasionan, en una primera etapa, parestesias y dolor nocturno(5); a medida que se cronifica, entumecimiento, quemazón(6), dolor tipo eléctrico con irradiación proximal(7) y debilidad o atrofia muscular en casos avanzados(4). Las ocurrencias de estas mononeuropatías son cada vez más frecuentes en consulta, aun así, sigue siendo una patología subdiagnosticada y de escasa recurrencia(8). Además, la variabilidad de etiologías y manifestaciones clínicas que presentan, así como el déficit de conocimiento anatómico por parte del clínico, suponen, a menudo, un reto diagnóstico(9).
En ocasiones el tratamiento conservador resulta no ser del todo efectivo, por lo que esto ha conllevado a incluir algunas terapias propias de especialidades como la fisioterapia para tratar al paciente con dolor crónico(10). La neuromodulación es una técnica relativamente actual definida por la Sociedad Internacional de Neuromodulación como “la alteración de la actividad nerviosa a través de la administración dirigida de un estímulo, como la estimulación eléctrica o agentes químicos, a sitios neurológicos específicos en el cuerpo”. Esta definición algo obsoleta es actualizada a mano de Albornoz y Maya, donde definen dicha técnica como “el uso de tecnologías avanzadas para mejorar o suprimir la actividad del sistema nervioso en el tratamiento de enfermedades, incluyendo dispositivos implantables o no implantables”(11).
Dentro de los procedimientos actuales descritos, y centrándonos en su aplicación sobre el sistema nervioso periférico (SNP), la estimulación eléctrica puede ser aplicada de forma transcutánea (TENS) o percutánea, de manera temporal (PENS) o implantada (PNS) (12). La PENS es definida por Fidalgo y cols.(13) como “la estimulación eléctrica de un nervio periférico mediante el uso de una aguja como electrodo para disminuir el dolor y restaurar las funciones neuromusculares y del sistema nervioso”.
Como profesionales de la salud debemos mantener actualizados nuestros conocimientos con el fin de poder brindar a nuestros pacientes la mejor asistencia sanitaria. Es por ello que con este trabajo pretendemos obtener la información y la evidencia necesaria para poner en un futuro los conocimientos en práctica.
Objetivos
Objetivo principal
Se realiza una revisión bibliográfica con el objetivo de valorar la efectividad de la técnica de estimulación eléctrica percutánea en el tratamiento del dolor neuropático/crónico ocasionado por los síndromes de atrapamiento nervioso más frecuentes en el pie y tobillo.
Objetivos secundarios
Material y métodos
Para la realización de la presente revisión bibliográfica se han valorado 29 artículos y 1 libro recopilados y seleccionados durante los meses de febrero y marzo de 2023 a través de las bases de datos de Pubmed, Dialnet, Science Direct, Scopus y la Biblioteca de Salud de la Universidad de Sevilla.
Las palabras clave utilizadas fueron: “nerve entrapment”, “pain”, “neuromodulation”, “PENS”, “Foot” y “ankle”. Todas ellas se combinaron entre sí utilizando los operadores boleanos “AND” y “OR”.
Criterios de inclusión:
Criterios de exclusión:
La amplia amplitud temporal ha sido seleccionada en función de la relevancia científica de estos estudios, tomando en cuenta el número de citas, la pertinencia del tema tratado, los protocolos y el método de aplicación utilizados, que pueden ser factibles de aplicar en el ámbito de la podología, así como las limitaciones presentes en la investigación actual.
Resultados
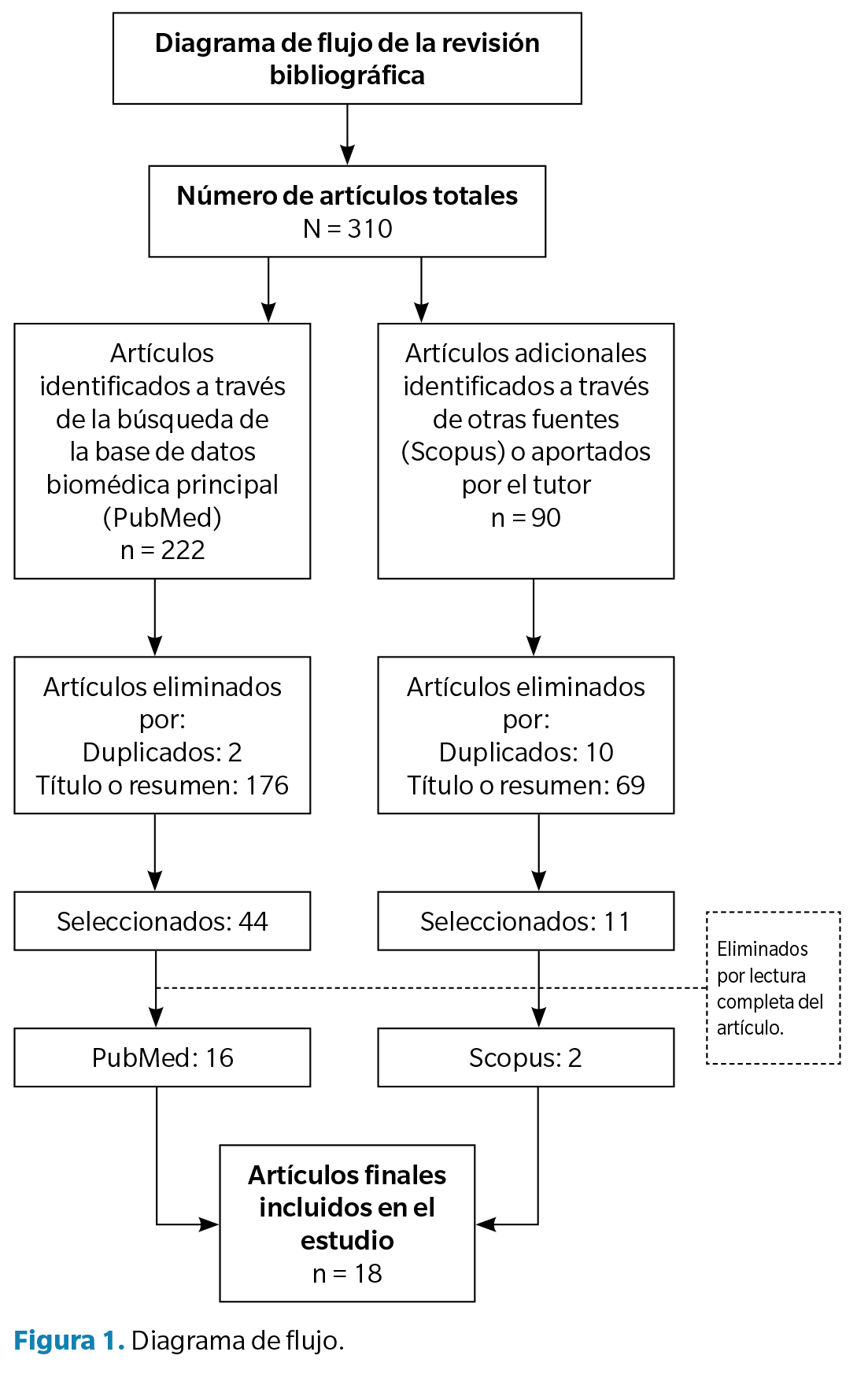
Para la valoración de los resultados se seleccionaron un total de 18 artículos. Con el propósito de representar de manera más esquemática la obtención de estos resultados, se elaboró un diagrama de flujo (Figura 1).

Eficacia de la terapia PENS para el tratamiento del dolor
Dolor musculoesquelético
En primer lugar, Plaza y cols.(14) en su estudio sugieren que la terapia con PENS, aplicada como único tratamiento, posee un efecto moderado sobre el dolor y la discapacidad relacionada. Además, encontraron que su combinación con otras intervenciones resultaba ser más efectiva, aunque esta suposición parecía ser dependiente de la población. Estos resultados mostraron su efectividad, aunque las pruebas eran escasas y valoradas a corto plazo.
Fidalgo y cols.(13) revisaron su aplicación en lesiones neuromusculoesqueléticas y encontraron que la técnica redujo significativamente el dolor y mejoró otros aspectos como fuerza y resistencia muscular, funcionalidad, equilibrio, discapacidad e ingesta de medicamentos.
Rodríguez y cols.(15) evaluaron los efectos de la terapia TENS y PENS sobre los mecanismos endógenos del dolor en pacientes que presentaran dolor musculoesquelético agudo o crónico. Concluyeron que ambas técnicas producen un efecto inmediato de leve a moderado en la hiperalgesia mecánica local, aunque no se pudo determinar si estos perduraban en el tiempo.
Dolor lumbar crónico
Weiner y cols.(16) encontraron que la terapia con PENS administrada dos veces por semana durante un mes y medio redujo el dolor y mejoró la función física durante seis meses. Además, la terapia fue más efectiva cuando se combinó con ejercicios aeróbicos y fisioterapia durante seis semanas.
Ghoname y cols.(17) demostraron que PENS fue más efectivo que TENS y el ejercicio a corto plazo, con una reducción inmediata del dolor del 82 %, en comparación con el 26 % y el 4 % de TENS y el ejercicio, respectivamente. Además, PENS redujo el uso de medicamentos en un 50 %.
Años más tarde, Yokoyama y cols. (18) determinaron que PENS resultó más efectiva después de 4 sesiones, y al aplicarla dos veces por semana durante 8 semanas, el alivio del dolor se mantuvo durante los siguientes 2 meses.
Dolor neuropático
La neuromodulación se ha convertido en una buena opción de tratamiento cuando el trastorno es resistente a otras terapias y los fenómenos de sensibilización e hiperexcitabilidad se instauran de forma definitiva(19).
Raphael y cols.(20) redujeron el dolor neuropático crónico e hiperalgesia superficial de 31 pacientes de 7.5 a 0.5 en la escala numérica de dolor (NRS), demostrando la eficacia analgésica de la estimulación a corto plazo.
Años después, Rossi y cols.(19) evaluaron un nuevo dispositivo PENS en 76 pacientes con dolor neuropático crónico periférico resistente a medicamentos. Su estudio demostró la efectividad y seguridad a corto, medio y largo plazo, proporcionando meses de alivio del dolor.
Dolor postoperatorio
Ilfeld y cols.(21) aplicaron una corriente eléctrica a través de la implantación de una sonda sobre el nervio ciático, el nervio femoral y el plexo braquial en una cirugía de pie, tobillo, ligamento cruzado anterior y manguito rotador. La estimulación se realizó durante 14 días postcirugía a 100 Hz y a 2 cm del epineuro. Como resultado se obtuvo que las puntuaciones de dolor y el consumo de opiáceos se redujeron al menos durante la primera semana tras la cirugía.
A pesar de los beneficios en la analgesia, la implantación de una sonda puede conllevar riesgos como infección, rotura, desprendimiento del cable o daño nervioso. Además de requerir cirugía y revisiones periódicas, solo un cirujano calificado puede realizarla (22).
Una terapia menos invasiva basada en su eficacia en el dolor musculoesquelético y neuropático, como PENS, podría ser una opción valiosa para el dolor postoperatorio agudo. Esto podría reducir riesgos y mejorar la satisfacción del paciente, por ejemplo, en cirugías como el abordaje del túnel tarsiano con dolor persistente postoperatorio.
Parámetros PENS para el dolor
La elección de los parámetros es controvertida debido a la falta de un protocolo universalmente aceptado. La frecuencia es considerada el parámetro más relevante según la mayoría de autores, a pesar de la diversidad de literatura al respecto(10,13).
Según exponen Beltrá y cols.(22), la plasticidad sináptica es “la capacidad de las sinapsis para fortalecerse o debilitarse con el tiempo, en respuesta a aumentos o disminuciones en su actividad”. Existen dos mecanismos de plasticidad sináptica con diferentes objetivos: deprimir la vía nociceptiva (LTD o long term depression) o potenciar la vía no nociceptiva (LTP o long term potentiation).
Klein y cols.(23) buscaron evaluar la modulación neuronal de larga duración en la percepción del dolor tras someterse a los protocolos LTD y LTP sobre la vía nociceptiva del dolor, es decir, sobre las fibras C. Aplicaron un tren de pulso continuo, 1 Hz durante 16 minutos y 40 segundos a dos intensidades: 10 y 20 veces el umbral de detección de cada individuo. La aplicación del protocolo de alta intensidad en la vía nociceptiva provocó estímulos dolorosos, aumentó las respuestas neuronales en el asta dorsal de la médula y generó vasodilatación, lo que sugiere que podría contribuir a la hiperalgesia neurogénica y el dolor crónico. Por otro lado, el protocolo de baja intensidad disminuyó la percepción del dolor, proporcionando analgesia durante más de una hora al inducir una depresión de las fibras nociceptivas, lo que podría ser beneficioso en pacientes con dolor crónico.
En base a la teoría del “gate control” de Melzack y Wall, propuesta en 1965, surgió la idea de investigación de Sdrulla y cols.(24) cuyo principal objetivo era evaluar cómo la potenciación sináptica a largo plazo (LTP) de las fibras Aβ (vía no nociceptiva) afecta a las respuestas de la vía nociceptiva induciendo una inhibición prolongada de la corriente postsináptica excitatoria evocada (eEPSC) por la llegada aferente de las fibras de alto umbral en las neuronas de la sustancia gelatinosa. Utilizaron diferentes frecuencias de estimulación y encontraron que las frecuencias más altas (50 y 1000 Hz) provocaron una mayor inhibición de las eEPSCs en animales tanto sanos como con daño nervioso.
Este protocolo podría resultar interesante en aquellos pacientes con dolor crónico o neuropático en los que se ha visto disminuida su capacidad para activar la vía descendente inhibitoria del dolor, ya que este protocolo podría utilizarse para provocar esa analgesia endógena mediante la potenciación de las fibras AB y la consecuente inhibición de transmisión nociceptiva de las fibras C en el asta dorsolateral de la médula.
Los estudios realizados por Klein y cols.(23) y Sdrulla y cols.(24) sirvieron de sustento al ensayo clínico realizado por Beltrá y cols.(22), en el que pretendían evaluar los efectos sensoriales y motores de ambos protocolos en individuos sin patología previa para así determinar cuál de los dos resultaba superior en la reducción de la percepción dolorosa. Evaluaron los efectos de estos inmediatamente y 24 horas después de estimular el nervio mediano. Los autores desarrollaron un nuevo protocolo LTP basado en los hallazgos previos de Sdrulla y cols.(24). Descubrieron que, utilizando pulsos de 100 Hz en 5 ráfagas de 5 segundos separadas por descansos de 55 segundos, podían inducir una depresión sináptica sobre la vía nociceptiva sin necesidad de aumentar la frecuencia. A su vez, crearon un protocolo LTD que consistía en estimulación a 2 Hz durante 16 minutos. Como resultado se obtuvo que el protocolo LTP condujo a una hipoalgesia distal sin afectar al rendimiento motor ni producir ninguna percepción dolorosa. Por otro lado, el protocolo LTD no causó hipoalgesia, redujo la fuerza y los individuos si percibieron sensaciones molestas.
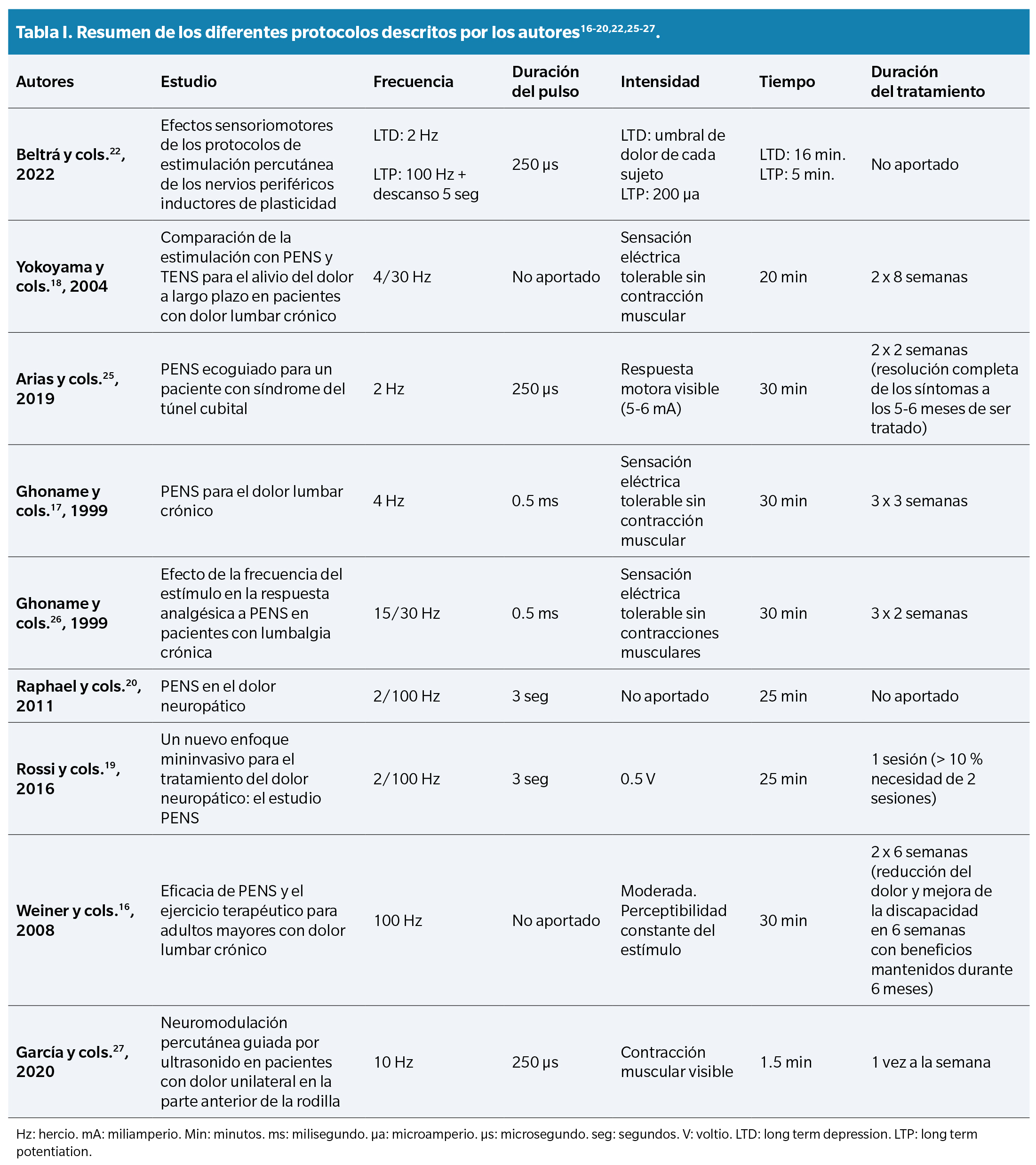
Al investigar la opinión de otros autores acerca de los diferentes parámetros de aplicación se encontraron diversas perspectivas y puntos de vista. Estos protocolos se exponen a modo resumen en la Tabla 1.
En cuanto al tiempo de aplicación, tanto Beltrá y cols.22, Yokoyama y cols. (18), Arias y cols.(25), como Fidalgo y cols.(13), coinciden en que aplicaciones más largas (> 15 minutos) proporcionan mejores resultados clínicos. Autores como Ghoname y cols.26, Fidalgo y cols.(13), Plaza y cols..(14), Rossi y cols.(19), Raphael y cols.(20) y Yokoyama y cols.18, están de acuerdo en que la combinación de frecuencias altas y bajas mejoran la efectividad de la terapia al activar receptores opioides (μ, δ y k) y en consecuencia diferentes tipos de opioides relacionados con el “gate control” (dinorfinas, encefalinas o endorfinas). Sin embargo, la diferencia radica en que el protocolo LTP de Beltrá y cols.(22) incluye cortos descansos entre los impulsos para evitar una depresión continua a nivel medular, mientras que otros protocolos no lo hacen. En el futuro, un estudio comparativo con un tamaño de muestra más amplio sería valioso para aumentar la evidencia científica y facilitar la aplicación clínica de estos protocolos.
Eficacia de la técnica PENS en la reducción del dolor ocasionado por los síndromes de atrapamiento nervioso
Ferreira y cols. (28) abordaron a un paciente con radiculopatía lumbosacra crónica que no respondía a tratamientos previos, incluyendo estimulación medular, al cual se le implantó un SNP percutáneo a lo largo del trayecto del nervio peroneo superficial. En solo dos semanas, el paciente experimentó una disminución del dolor, de 8/10 a 1/10 en la escala NRS, junto con mejoras en la movilidad. La analgesia se mantuvo cuando se revaluó después de tres meses. Estos resultados sugieren que esta técnica puede ser una alternativa efectiva para pacientes con compresión nerviosa que no han respondido a otras opciones de tratamiento.
En otro caso, Langford y cols. (29) presentaron el caso de un hombre de 57 años con meralgia parestésica crónica. Después de que el tratamiento farmacológico causara efectos secundarios, se sometió a estimulación periférica implantada quirúrgicamente, lo que redujo su dolor (de 8/10 a 0/10 en la escala NRS). A pesar de retirar el dispositivo después de 2 meses, el alivio del dolor persistió durante 1 año.
En 2020, García y cols.(27) llevaron a cabo un ensayo clínico aleatorizado para investigar los efectos de la técnica PENS a corto plazo al aplicarla sobre el nervio femoral en pacientes con dolor inespecífico en la parte anterior de la rodilla, considerando que podría deberse a un atrapamiento nervioso, entre otras hipótesis. Los resultados indicaron mejoras en el dolor, funcionalidad y rango de movimiento de los pacientes durante una semana después de una sola estimulación. Los autores sugieren aplicar esta terapia semanalmente, aunque no especifican la duración total del tratamiento.
En el mismo año, Fernández y cols.(30) presentaron un caso de un paciente de 48 años con neuropatía ocasionada por el síndrome del túnel cubital. A pesar de un año con sintomatología, y de un intento previo sin éxito con tratamientos conservadores durante seis meses, se sometió a tres sesiones con PENS realizadas una vez por semana. En cada sesión se aplicó una frecuencia de 2 Hz durante 30 minutos. La mejoría se observó después de la tercera sesión, lo que llevó a la incorporación de ejercicios de deslizamiento activo durante 2-3 semanas. Un mes después de la última sesión, el paciente experimentó una mejoría que duró un año sin necesidad de intervenciones adicionales.
En 2019, Arias y cols.(25) presentaron el caso de un paciente de 43 años que inicialmente fue diagnosticado con epicondilalgia lateral de codo. Tras experimentar una mejoría durante dos años, sufrió una recaída después de golpearse realizando actividad física. A pesar de tratamientos conservadores, fisioterapia y ejercicios, el dolor no cesaba, además de presentarse con cualidades eléctricas e irradiarse por el antebrazo. Los síntomas clínicos actuales sugerían la presencia de un posible síndrome del túnel radial. Tras una intervención con PENS sobre el tronco del nervio radial y el nervio interóseo posterior, además de un programa de ejercicios de 4 semanas, el paciente experimentó una mejoría en el dolor y la función, logrando una resolución completa de los síntomas en los 5-6 meses posteriores.
Discusión
La técnica PENS parece prometedora en el tratamiento de atrapamientos nerviosos, aunque la evidencia actual es limitada, principalmente basada en informes de casos. Además, la falta de investigaciones específicas en el pie y el tobillo representa una brecha en el conocimiento de la especialidad.
Desde el inicio de nuestra investigación, buscamos ampliar nuestros conocimientos intercambiando experiencias con profesionales de la fisioterapia y la podología que emplean la técnica PENS. Inicialmente, consultamos a un fisioterapeuta experto en estimulación nerviosa para adquirir los conocimientos necesarios, dada la falta de profundidad con la que se aborda este tema en el grado de Podología. Sin embargo, al profundizar en nuestra revisión bibliográfica, notamos la carencia de estudios que respaldaran la eficacia de PENS en el tratamiento del dolor originado por atrapamientos nerviosos en el pie y el tobillo. Como consecuencia, nos pusimos en contacto con dichos especialistas con la intención de presenciar telemática y personalmente los buenos resultados que todos ellos referían con respecto a su aplicación en diferentes casos de atrapamientos nerviosos como neuroma de Morton, neuroma de Hausser o síndrome del túnel del tarso, entre otros.
Hemos podido comprobar el alto nivel de satisfacción del paciente en cuanto a la disminución del dolor y la mejora de la funcionalidad, tanto en los casos clínicos proporcionados como en los que hemos presenciado. Aunque los resultados que se obtienen en base a la experiencia de cada profesional son positivos, cabe destacar que cada uno de ellos utiliza diferentes protocolos de actuación en cuanto a parámetros/dosificación (frecuencia y tiempo), colocación de la aguja o tipo de dispositivo, entre otros.
Finalmente, y por dicho motivo, valoramos la conveniencia de realizar en un futuro próximo un estudio con el diseño metodológico adecuado en el que se evalúe la efectividad de la técnica PENS para el dolor ocasionado por los atrapamientos nerviosos más frecuentes del pie y tobillo, con la intención de poder dejar recogidos y demostrados los buenos resultados que hemos podido apreciar en la práctica clínica.
Conclusiones
La técnica ha demostrado efectividad a corto plazo en cuanto a la reducción del dolor musculoesquelético, neuropático o postoperatorio, así como la ingesta de medicamentos. Los autores contrastados utilizan diferentes protocolos de actuación. Si bien la mayoría alternan altas y bajas frecuencias en un intervalo de 20-30 minutos.Existen dificultades para evidenciar la efectividad de la técnica PENS en los síndromes de atrapamiento nervioso en el pie y tobillo, aunque sí para los ocasionados en otras partes del cuerpo.
Conflictos de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiación
Ninguna.
Contribución de los autores
Concepción y diseño del estudio: LRF.
Recopilación de datos: LRF.
Análisis e interpretación de resultados: LRF.
Creación, redacción y preparación del borrador inicial del artículo: LRF, MMF.
Revisión y aceptación versión final previa publicación: LRF, MMF, RMD.
Bibliografía