DOI: http://dx.doi.org/10.20986/revesppod.2023.1656/2022
NOTA CLÍNICA
Tratamiento de pseudoartrosis postquirúrgica en la base del segundo metatarsiano mediante autoinjerto de calcáneo: caso clínico
Treatment of postsurgical pseudoarthrosis in the base of the second metatarsal with calcaneus autograft: a case report
Sergio Miralles Ruíz1, Víctor Mateos Selma1 y Javier Pascual Huerta2
1Clínica Podológica Sergio Miralles. Castellón de la Plana, España
2Clínica del Pie Elcano. Barakaldo. Vizcaya, España
Resumen
Los procesos de no-unión postquirúrgicos en pie y tobillo no son infrecuentes debido a la gran cantidad de procedimientos quirúrgicos mediante osteotomías o artrodesis que se realizan anualmente. Ocasionalmente, estos procedimientos no tienen una estabilización óptima del foco de fractura y pueden acabar degenerando en un proceso de no-unión. Presentamos el caso de una paciente a la que se le realizaron osteotomías en la base de los metatarsianos menores por cirugía mínimamente invasiva para el tratamiento de metatarsalgia, que derivó en el desarrollo de pseudoartrosis dolorosa en la base del segundo metatarsiano y de no-unión en el 4.º metatarsiano. Se realizó tratamiento quirúrgico consistente en la utilización de autoinjerto corticoesponjoso de calcáneo y estabilización con placa de bloqueo dorsal para 2.º metatarsiano y estabilización con placa dorsal de bloqueo para el 4.º metatarsiano. La radiología mostró integración del injerto a las 8 semanas y los resultados clínicos fueron muy satisfactorios tras 5 años de seguimiento. El autoinjerto de calcáneo con estabilización rígida por medio de placa de bloqueo dorsal puede ser un tratamiento efectivo para el tratamiento de la no unión y pseudoartrosis en la base de los metatarsianos.
Palabras clave: No-unión, pseudoartrosis, retraso consolidación, injerto óseo, autoinjerto, osteotomía metatarsal, metatarsiano, calcáneo, cirugía.
Abstract
Postsurgical nonunions of the foot and ankle are not uncommon because of the large number of procedures by means of osteotomies and arthrodesis that are performed annually. We present a clinical case of a patient who developed a painful nonunion in the base of the second metatarsal after a minimally invasive surgical procedure for metatarsalgia within a base osteotomy that developed a painful pseudoartrhosis of the 2nd metatarsal and also a nonunion of the 4th metatarsal. The patient was treated with the use of an autograft of corticocancellous bone from ipsilateral calcaneus that was fixated with a dorsal locking plate for the 3rd metatarsal and also with stabilization by means of a dorsal locking plate of the 4th metatarsal. Radiology showed good integration of the graft at 8 weeks and clinical results were excellent after 5 years of followup. Autograft from calcaneus fixed with a locking dorsal plate can be an effective treatment of nonunions in the base of the metatarsals.
Keywords: Nonunion, pseudoarthrosis, delay consolidation, bone graft, autograft, metatarsal osteotomy, metatarsal, calcaneus, surgery.
Recibido: 28-12-2022
Aceptado: 08-03-2023
Correspondencia: Javier Pascual Huerta
javier.pascual@hotmail.com
Introducción
Las osteotomías metatarsales son actualmente procedimientos comúnmente utilizados para el tratamiento quirúrgico de las alteraciones del antepié1-3. Sin embargo, estas osteotomías no están exentas de complicaciones, y las alteraciones de la consolidación ósea forman parte de las complicaciones locales de las osteotomías metatarsales. La curación ósea, tras una fractura u osteotomía, conlleva un proceso biológico de reparación complejo en el que intervienen una gran multitud de factores endógenos y exógenos4-6. Si el resultado final de este proceso se ve alterado en cualquiera de sus formas, pueden aparecer complicaciones en la consolidación ósea. Estas alteraciones en la consolidación pueden clasificarse en: retraso de la consolidación, no-unión y pseudoartrosis7.
Los términos de no-unión y pseudoartrosis han sido utilizados de forma sinónima en la literatura europea durante años, con el término de pseudoartrosis cubriendo ambas entidades: no-unión y pseudoartrosis o formación de “falsa articulación”7. Sin embargo, actualmente se considera la pseudoartrosis como una entidad clínica diferente, causada por una estabilización inadecuada del foco de fractura en la que se crea una falsa articulación formada por una cavidad fibrocartilaginosa que produce líquido sinovial originado por la producción local de suero. En este sentido, podría considerarse como un estadio más de una no-unión y como un proceso irreversible en el que se forma una pseudoarticulación fibrocartilaginosa con un recubrimiento sinovial, sin posibilidad de que pueda producirse la consolidación8-10.
Las causas principales de la no-unión y de la pseudoartrosis son el exceso de movimiento en el lugar de la fractura (estabilidad mecánica insuficiente) y la insuficiente vascularización de los fragmentos óseos que evita un aporte sanguíneo óptimo para la consolidación de la fractura. Clínicamente se manifiestan por la presencia de dolor con la solicitación funcional del hueso y edema local con un grado variable de impotencia funcional. Los criterios para definir una no-unión no se encuentran perfectamente estandarizados, especialmente con respecto a la transición de unión retrasada a no-unión11. La FDA (Food and Drug Administration) define la no-unión como la curación incompleta de una fractura u osteotomía después de 9 meses desde el comienzo de la lesión junto con la ausencia de signos de curación en pruebas radiológicas seriadas durante 3 meses consecutivos12.
El tratamiento de estas lesiones consiste en refrescar los extremos óseos, retirando todo el tejido fibrocartilaginoso y tejido sinovial y exponiendo hueso “fresco”, que permita una consolidación de la fractura. Esta nueva fractura creada debe ser estabilizada de forma eficaz nuevamente para evitar nuevos problemas de consolidación. En caso de que este tratamiento pueda generar mucho acortamiento, se puede interponer injerto óseo para evitar el defecto en longitud.
El presente artículo expone un caso clínico de pseudoartrosis dolorosa en la base del 2.º metatarsiano y de no unión en base del 4.º metatarsiano en un mismo paciente con objeto de estimular el debate de estas entidades dentro de la comunidad podológica. El tratamiento llevado a cabo se realizó mediante la utilización de injerto óseo autólogo de calcáneo y estabilización con placa dorsal en la base del 2.º metatarsiano y estabilización con placa dorsal en 4.º metatarsiano. Para la realización del presente artículo se siguieron las recomendaciones de la guía CARE para el reporte de casos clínicos13.
Caso clínico
Se presenta el caso clínico de una paciente de 56 años de edad, sexo femenino y raza blanca, que acude a la Clínica Podológica Miralles (Castellón, España), el 21 de abril de 2015, refiriendo dolor intenso a la carga en el dorso del pie derecho localizado en la zona de las bases de metatarsianos centrales. La paciente había sido intervenida quirúrgicamente 9 meses antes (10 de septiembre de 2014) mediante la realización de osteotomías completas por cirugía mínimamente invasiva en las bases de segundo, tercer y cuarto metatatarsianos del pie derecho con la finalidad de elevar los metatarsianos como tratamiento de la metatarsalgia mecánica que padecía. La cirugía se llevó a cabo sin fijación con carga inmediata en un calzado postquirúrgico. La paciente no presentaba alergias medicamentosas conocidas ni antecedentes personales médico-quirúrgicos relevantes con el presente caso, salvo los mencionados con la intervención quirúrgica del pie derecho. No fumadora, trabajaba como auxiliar de enfermería y también era propietaria de una cafetería por las tardes, con una ocupación laboral en bipedestación prolongada superior a 10 horas diarias.
En la exploración clínica se observó la presencia de edema en el dorso del pie derecho con dolor a la palpación de las bases de los metatarsianos centrales, y más específicamente dolor a la flexión dorsal y plantar del segundo metatarsiano. En la exploración vascular la paciente presentaba pulso pedio y tibial posterior palpables y la exploración neurológica realizada con el monofilamento Semmens-Weinstein reveló que mantenía intacto el umbral de protección dolorosa.
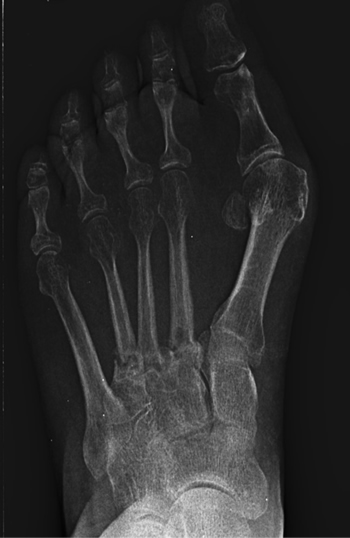
Se realizó radiografía dorso-plantar en carga del pie derecho (Figura 1) que mostraba una imagen radiológica compatible con ausencia de consolidación de las osteotomías en las bases de 2.º, 3.º y 4.º metatarsianos, además de la presencia de hallux abductus valgus. Se solicitó una tomografía axial computarizada (TAC) para estudiar más detenidamente el estado actual del proceso de consolidación ósea. La paciente acudió con resultado de TAC el 5 de mayo de 2015, donde se evidenció la ausencia completa de consolidación ósea en segundo metatarsiano (Figuras 2A y 2B), consolidación prácticamente completa de tercer metatarsiano (Figura 2C) y la presencia de callo óseo con consolidación incompleta en el cuatro metatarsiano (Figura 2D).

Figura 1. Radiografía dorso-plantar en carga del pie derecho. Se evidencia la ausencia de consolidación de las osteotomías en las bases de 2.º, 3.º y 4.º metatarsianos después de 9 meses de la intervención inicial.
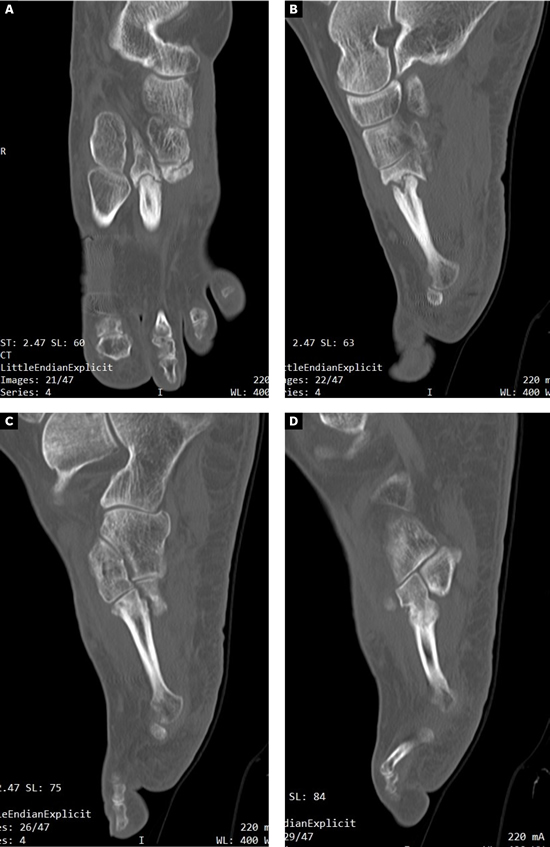
Figura 2. Radiografía dorso-plantar en carga del pie derecho. Se evidencia la ausencia de consolidación de las osteotomías en las bases de 2.º, 3.º y 4.º metatarsianos después de 9 meses de la intervención inicial.
Se diagnosticó entonces de pseudoartrosis en segundo metatarsiano y de retraso de la consolidación en cuarto metatarsiano, además de la deformidad de hallux abductus valgus. Se explicaron a la paciente las opciones de tratamiento conservador basado principalmente en reposo, magnetoterapia y posibles infiltraciones de plasma rico en plaquetas y de tratamiento quirúrgico. Como tratamiento quirúrgico se le propuso en el segundo metatarsiano la limpieza de la pseudoartrosis, colocación de autoinjerto corticoesponjoso (obtenido de calcáneo) para dotar de soporte estructural y mantener la longitud del metatarsiano, y estabilización con placa dorsal. Además, se propuso estabilizar el cuarto metatarsiano mediante el uso también de placa dorsal para asegurar su no evolución hacia pseudoartrosis y corregir la deformidad en hallux abductus valgus. La paciente desestimó el tratamiento conservador, solicitando tratamiento quirúrgico, y se realizó preoperatorio con analítica sanguínea, electrocardiograma y consulta preoparatoria con anestesista.
Con fecha 16 de junio de 2015 se realizó la intervención quirúrgica bajo sedación consciente y con anestesia raquídea. Se usaron 2 g de cefazolina intravenosa como profilaxis antibiótica previamente al inflado del torniquete colocado en el tobillo a una presión de 230 mm Hg. Se realizaron cuatro incisiones: una incisión medial para la corrección del hallux abductus valgus, una incisión dorsal sobre segundo metatarsiano, otra incisión dorsal sobre cuarto metatarsiano, y una cuarta incisión en la zona posterior lateral del calcáneo derecho para la obtención del autoinjerto. A través de la primera incisión, se realizó la corrección del hallux valgus con liberación de la contractura lateral vía intrarticular, liberando el ligamento suspensorio y con tenotomías de la cabeza lateral del flexor corto del hallux y del abductor del hallux, junto con osteotomía de Scarf en el primer metatarsiano fijado con un tornillo tipo Herbert (3.0 mm META SCREW® con rosca larga de 20 mm) (Debramedix; Almoradi, Alicante, España) y osteotomía de Akin en la falange proximal (fijado con grapa medial). A través de la segunda incisión en el segundo metatarsiano, se realizó desbridamiento y limpieza de la zona de la pseudoartrosis (Figura 3A). Se midió la longitud del defecto óseo, que era 7 mm, y se obtuvo el autoinjerto de calcáneo del pie derecho (Figuras 4A y 4B) para luego implantarlo en el metatarsiano (Figura 3B). El defecto de calcáneo fue rellenado con sustituto óseo sintético, una cerámica sintética de hidroxiapatita 65 % y fosfato tricálcico 35 % (CERAFORM®, Tecknimed; L’union, France). El autoinjerto de calcáneo utilizado es principalmente de hueso esponjoso y presenta hueso cortical obtenido de las paredes dorsal y lateral del calcáneo, de manera que se situó la porción del injerto con cortical en posición dorsal para resistir mejor las fuerzas de compresión a la carga. Se estabilizó con placa de bloqueo en “T” (miniplaca en T 2/4 orificios 30 x 5 mm con tornillo bloqueado de 2.0 mm) (Debramedix; Almoradi, Alicante, España)(Imagen 8). A través de la tercera incisión se realizó una estabilización del cuarto metatarsiano con placa recta dorsal (miniplaca recta 5 orificios 29 x 5 mm con tornillos bloqueados de 2.0 (Debramedix; Almoradi, Alicante, España). Se realizó finalmente un bloqueo postoperatorio local con 8 ml de bupivacaína 0.5 % junto con 2 cc de betametasona (Celestone®Cronodose®, Schering-Plough; New Jersey, USA). La Figura 5 muestra la radiografía postoperatoria.
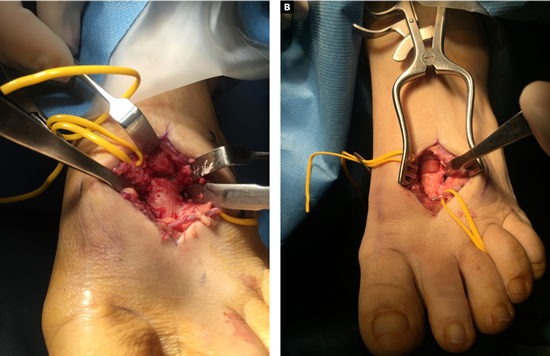
Figura 3. A: imagen intraoperatoria del 2.º metatarsiano después de realizar desbridamiento y limpieza de toda la zona de la pseudoartrosis. B: imagen intraoperatoria de la colocación del autoinjerto de calcáneo. Nótese cómo la porción cortical del injerto se sitúa en la cara dorsal para resistir mejor las fuerzas de compresión a la carga.
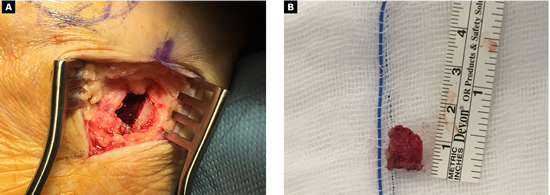
Figura 4. A: incisión en la zona posterior y lateral del calcáneo del pie derecho para la obtención del injerto. Nótese que el autoinjerto se obtiene del reborde lateral y dorsal del calcáneo, lo que permite obtener un injerto con gran cantidad de hueso esponjoso y a su vez con un borde compuesto por hueso cortical que ayuda a dar estabilidad estructural al injerto para poder soportar fuerzas de compresión. B: imagen del autoinjerto obtenido del calcáneo.
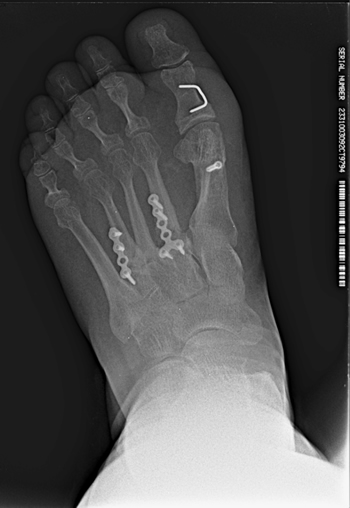
Figura 5. Imagen postoperatoria tras la cirugía.
Como vendaje postoperatorio se colocó una férula posterior de yeso y uso de muletas dando instrucciones a la paciente de no apoyar el miembro intervenido de forma estricta durante 8 semanas. Se pautó terapia antitrombótica con Clexane® 40 ml/g con una pauta de 1/24 horas durante las 8 semanas de ausencia de carga. Se pautó igualmente ibuprofeno 600 mg cada 8 horas para el dolor postquirúrgico con parecetamol de 1 g intercalado cada 4 horas a modo de analgesia de rescate durante los primeros 3-5 días postoperatorios.
El postoperatorio transcurrió sin incidencias y se realizaron curas postoperatorias con suero fisiológico y povidona yodada a los 7, 21 y 49 días postoperatorios. A las 6 semanas y 2 días (30 de julio de 2015) se realizó TAC de control que fue valorado el 7 de agosto de 2015 (7 semanas y 3 días tras la intervencion). Este TAC evidenciaba buena integración del injerto. Tras este hecho, junto con la favorable evolución clínica, se permitió a la paciente la carga parcial con bota tipo Walker durante 3 semanas para posteriormente comenzar a utilizar calzado convencional de forma progresiva.
A los 5 meses de la intervención se solicitó nuevamente un TAC comparativo que se realizó el 20 de noviembre de 2015 (Figura 6) que evidenció la integración completa del injerto y la consolidación del 4.º metatarsiano. La evolución clínica de la paciente fue muy positiva con ausencia completa de dolor realizando todas las actividades de la vida diaria con normalidad. Con fecha 25 de mayo de 2016 (11 meses postoperatorios) se realizó última visita de la paciente encontrándose esta en perfectas condiciones y dando el alta a la paciente. La paciente ha sido seguido posteriormente con revisiones anuales durante 4 años (hasta 2019) sin ninguna alteración.
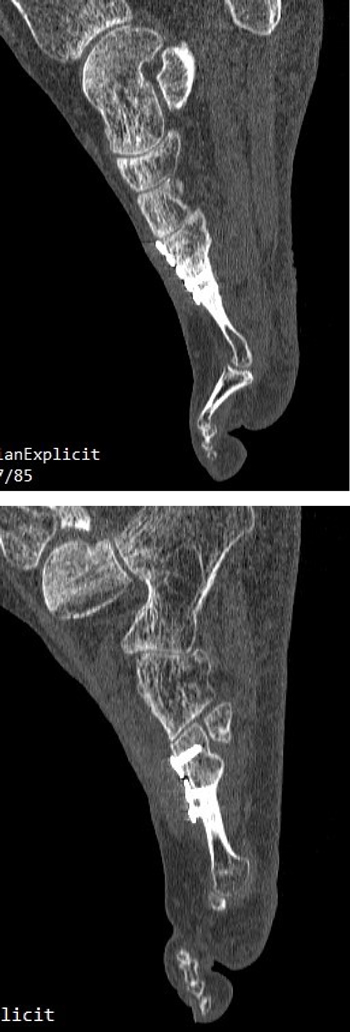
Imagen 6. TAC postoperatorio a los 5 meses. 6A. Imagen del 2º metatarsiano que muestra integración del injerto con la placa dorsal. 6B. Imagen del 4º metatarsiano que muestra consolidación del 4º metatarsiano.
Discusión
La curación del hueso es un proceso orquestado y altamente complejo que engloba un número importante de factores como la presencia de células osteoprogenitoras, células inflamatorias, endoteliales, hematopoyéticas, sustancias mediadoras osteoinductivas, la presencia de una adecuada matriz osteoconductiva, adecuado aporte sanguíneo al foco de fractura y suficiente estabilización mecánica14,15. Al contrario que muchos otros tejidos en el cuerpo humano, el hueso tiene la capacidad de reparación, formando directamente un nuevo tejido óseo sin la necesidad de dejar un tejido cicatrizal en el foco de fractura. En este sentido, el éxito de la curación de las fracturas u osteotomías, así como de la integración del hueso y de su remodelado, depende altamente de la estabilidad mecánica de la fractura y de su aporte vascular. Fracturas estables en las que los extremos óseos están bien aposicionados y presentan una estabilización mecánica adecuada como para soportar las fuerzas de carga con aporte vascular óptimo curarán inicialmente por osificación directa (curación “primaria”)16. Por su parte, las fracturas que no presentan una buena estabilización mecánica conllevan un proceso de curación ósea diferente (osificación “secundaria” o indirecta) con la formación de un tejido cartilaginoso intermedio (callo blando) con el que se obtiene la estabilización del foco de fractura. Esta estabilización mediante tejido cartilaginoso aporta suficiente rigidez como para permitir la nueva formación de vasos sanguíneos que aporte vascularización junto con la invasión de osteoblastos que transforman el callo blando en callo óseo de forma gradual17. Es decir, es el entorno mecánico de la fractura el que dicta o determina el comportamiento biológico de la misma18.
Aunque el proceso biológico exacto que acaba desencadenando una no-unión no se entiende completamente debido al alto número de factores intrínsecos y extrínsecos que influyen en la curación del hueso12,19, es universalmente aceptado que fracturas altamente inestables son propensas a no curar7,20. La presencia de micromovimiento interfragmentario con pequeñas cantidades de deformación en el foco de fractura se ha encontrado que puede estimular tanto la osificación endocondral como intramembranosa; sin embargo, grandes cantidades de deformación o movimiento excesivo en el foco de fractura producen una rotura del callo blando cada vez que este intenta formarse, llevando a la deposición de tejido conectivo (no tejido óseo) en el foco de fractura que a la larga puede acabar degenerando en la producción de una no-unión21-23. El caso presentado desarrolló un retraso en la consolidación degenerando en pseudoartrosis en la base del segundo metatarsiano junto con un retraso de consolidación del cuarto metatarsiano debido a la presencia de una inadecuada estabilización mecánica de las osteotomías en la base de los metatarsianos. En este sentido, es interesante señalar que osteotomías metatarsales en la base de los metatarsianos presentan un alto potencial de inestabilidad en el foco de fractura debido las fuerzas deformantes en flexión dorsal que se producen por el alto brazo de palanca que realizan las fuerzas reactivas del suelo al actuar sobre la cabeza metatarsal. Es aconsejable que la realización de osteotomías metatarsales sin el uso de fijación han de cumplir el precepto de ir a favor de carga para que las fuerzas reactivas del suelo no desplacen la osteotomía y siempre que sea posible realizarse en la zona distal de la cabeza metatarsal, donde el brazo de palanca y las fuerzas deformantes en flexión dorsal son menores. En el caso de las ostetomías de base hay que tener en cuenta que el control de esas fuerzas se dificulta debido al mayor brazo de palanca24,25. Este efecto queda muy limitado en las osteotomías capitales de los metatarsianos. La inestabilidad de las osteotomías con exceso de movimiento cuando el paciente se somete a carga fisiológica puede provocar patología de la consolidación como el retraso de la consolidación no-unión y/o pseudoartrosis, debido a que el callo blando no puede calcificar por el movimiento y la inestabilidad mecánica a la que está sometido26. En el caso presentado, encontramos 2 de estas alteraciones: retraso de consolidación y no-unión con pseudoartrosis, estando ambas relacionadas con la falta de estabilidad de las osteotomías.
El tratamiento eficaz de no-uniones, especialmente las refractarias a tratamiento conservador supone actualmente un reto considerable para la práctica clínica y su tratamiento óptimo es un aspecto debatible actualmente en la literatura científica. Es importante tener en cuenta que el manejo de cualquier proceso de no-unión engloba dos componentes críticos de la curación de fracturas: el soporte estructural de la no-unión (estabilidad mecánica) y el componente biológico (aporte sanguíneo y de componentes celulares y sustancias mediadoras)14,15,26. Una vez se produce la pseudoartrosis, y esta es sintomática, autores recomiendan una nueva reintervención para refrescar los extremos de la osteotomía, el uso de injertos óseos y el uso de estabilización mediante fijación rígida (interna o externa) de la no-unión27,28.
En el presente caso se optó por realizar tratamiento quirúrgico en el segundo metatarsiano mediante refrescado de los bordes óseos (para limpiar todo el tejido fibroso y sinovial creado en la psuedoartrosis), el uso de autoinjerto y la estabilización mediante fijación interna rígida mediante placa de bloqueo dorsal. Igualmente, la paciente tuvo un postoperatorio sin carga de 8 semanas acompañado posteriormente de una carga progresiva por 3 semanas mediante bota Walker. Sin embargo, en el 4.º metatarsiano decidió realizar únicamente una estabilización del callo óseo mediante placa dorsal sin necesidad de realizar un refrescado de los bordes óseos, ya que el TAC realizado mostraba la presencia de no-unión en el 4.º metatarsiano sin pseudoartrosis que se sospechaba estaba producida por falta de estabilización mecánica del foco de fractura.
Existen diversos tipos de injertos óseos que pueden ser utilizados en cirugía de pie y tobillo de forma efectiva cuando se pretende rellenar un defecto óseo creado. Estos injertos pueden ser injertos autógenos provenientes del propio paciente (autoinjertos), aloinjertos, xenoinjertos o injertos de hueso sintético29. El injerto autógeno de hueso es todavía considerado el “gold standard” para aumentar el índice de curación en casos de artrodesis o no de no unión. Es ideal en muchas situaciones, ya que es obtenido del propio paciente y presenta un riesgo mínimo de rechazo y más fácil de ser incorporado que los aloinjertos o xenoinjertos. A su vez, tiene propiedades osteogénicas, osteoconductivas y osteoinductivas de alta calidad, por lo que su utilización en casos de no-unión merece ser siempre considerada30. Sin embargo, la obtención de autoinjerto añade un procedimiento extra a la cirugía y siempre pueden aparecer complicaciones en el lugar de la donación del injerto, aspecto que se elimina con el uso de aloinjertos o injertos sintéticos31,32. En este caso se colocó un autoinjerto de calcáneo del mismo pie para mantener la longitud del segmento óseo. El injerto de calcáneo es un injerto corticoesponjoso bicortical que ha sido ha sido utilizado con éxito en diferentes casos de cirugía de pie y tobillo33,24 y cuya morbilidad asociada a la zona donante en el calcáneo parece ser bastante reducida35-37. Este injerto corticoesponjoso mantiene la cortical del calcáneo obtenida de la zona dorsal y lateral del calcáneo, por lo que no es únicamente un injerto esponjoso38. Este aspecto permite utilizarlo en situaciones de huesos sometidos a carga, como en este caso, que se utilizó colocando la parte cortical del injerto en la dorsal del segundo metatarsiano para resistir las fuerzas de compresión dorsal que se producen a dicho nivel en situaciones de carga. Posteriormente, la estabilización se realizó con placa de bloqueo dorsal y se mantuvo a la paciente en descarga durante 8 semanas para posteriormente pasar a carga parcial mediante bota tipo Walker. La evolución del caso clínico fue buena consiguiendo la eliminación de los síntomas dolorosos de la paciente en carga con la consolidación completa del 2.º y 4.º metatarsianos, tal y como se evidenció en los TAC postoperatorios posteriores.
En conclusión, el presente artículo muestra un caso clínico de una no-unión con pseudoartrosis en la base de 2.º metatarsiano y de no-unión en la base de 4.º metatarsiano tras una cirugía previa de elevación metatarsal. La paciente fue tratada de forma quirúrgica mediante la utilización de autoinjerto óseo de calcáneo en el 2.º metatarsiano junto con estabilización mediante fijación rígida mediante el uso de placa dorsal de bloqueo y con estabilización de la no-unión del 4.º metatarsiano con la utilización igualmente de placa dorsal de bloqueo. Este caso clínico pone de manifiesto la importancia de la estabilización en este tipo de osteotomías y la posibilidad de utilización de injerto de calcáneo como fuente de autoinjerto en defectos óseos en el pie.
Conflicto de intereses
No hay conflicto de intereses por parte de los autores.
Financiación
Ninguna.
Bibiografía